Structure | 中国科学院分子细胞科学卓越创新中心丁建平组阐明去泛素化酶STAMBP的活性调控机制
AutophagyAdvances
2025-05-31 10:14
文章摘要
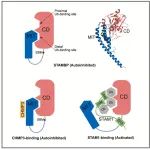
本研究由中国科学院分子细胞科学卓越创新中心丁建平研究组完成,首次阐明了去泛素化酶STAMBP的全长蛋白活性调控机制。研究发现,STAMBP的MIT结构域通过占据催化结构域(CD)的底物结合位点,对酶活性产生自抑制作用。通过解析MIT-CD复合物的晶体结构和体外功能分析,证实了这种自抑制作用的分子基础。此外,研究还发现STAM1的结合能增强全长蛋白活性,而CHMP3的结合则无此效应。该研究为理解ESCRT介导的受体回收过程中STAMBP的功能提供了重要分子机制。
本站注明稿件来源为其他媒体的文/图等稿件均为转载稿,本站转载出于非商业性的教育和科研之目的,并不意味着赞同其观点或证实其内容的真实性。如转载稿涉及版权等问题,请作者速来电或来函联系。
推荐文献
Enzymatic Synthesis of 2-Amino-adenosine Triphosphate as a Noncanonical Nucleotide Precursor of Z-Modified RNA.
DOI: 10.1021/acssynbio.5c00890
Pub Date : 2026-02-06
Protocol for Discovery and Characterization of Miniature Cas12 Systems.
DOI: 10.1021/acschembio.6c00016
Pub Date : 2026-02-06
TMEM55B-Jack of all trades in the endo-lysosomal system?
DOI: 10.1016/j.str.2025.12.012
Pub Date : 2026-02-05
AutophagyAdvances

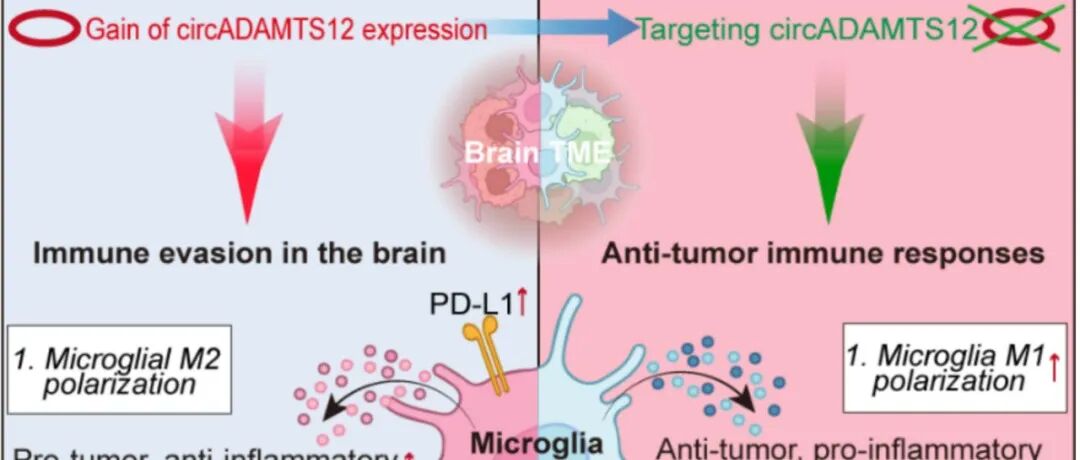
Cell Death Dis | 复旦大学李继喜团队揭示脑胶质瘤恶性进展新机制.
2025-12-31
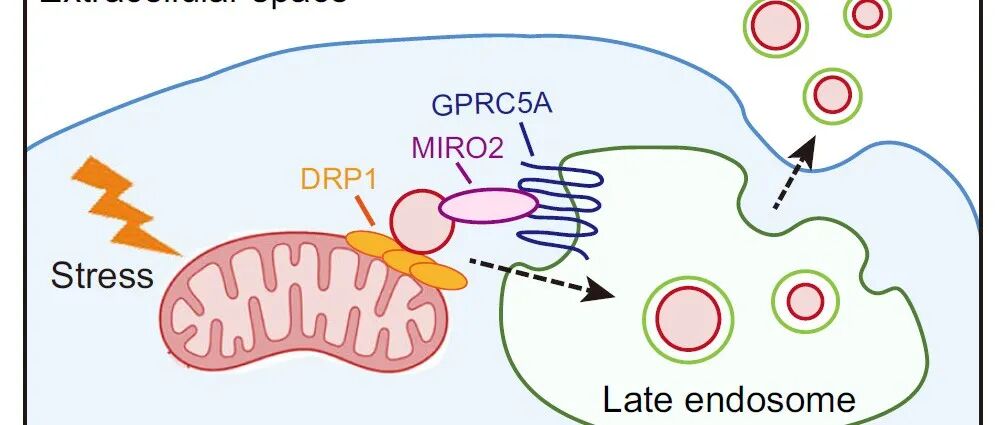
Nat Commun丨香港中文大学尹玉新团队揭示肺泡上皮细胞线粒体质量控制新机制.
2025-12-31
Autophagy | 中山大学李民团队揭示核心自噬E1酶ATG7的双重作用.
2025-12-31

中国药科大学杨涛课题组诚聘博士后/科研助理.
2025-12-31
Cancer Res丨南京医科大学陈礼明团队发现乳腺肿瘤脑转移新机制和潜在新疗法.
2025-12-30
最新文章

中国药科大学杨涛课题组诚聘博士后/科研助理
2025-12-31

Autophagy | 中山大学李民团队揭示核心自噬E1酶ATG7的双重作用
2025-12-31

Nat Commun丨香港中文大学尹玉新团队揭示肺泡上皮细胞线粒体质量控制新机制
2025-12-31

Cell Death Dis | 复旦大学李继喜团队揭示脑胶质瘤恶性进展新机制
2025-12-31




