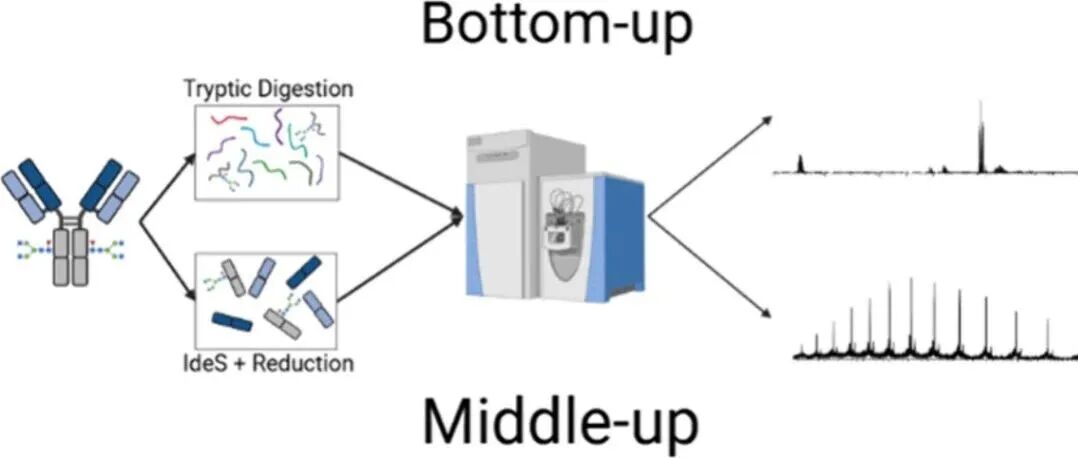
Proc. Natl. Acad. Sci. USA|非典型去折叠酶ANGPTL3/8通过催化脂蛋白脂肪酶的去折叠调节血管内脂解
李惠琳课题组
2025-10-30 06:37
文章摘要
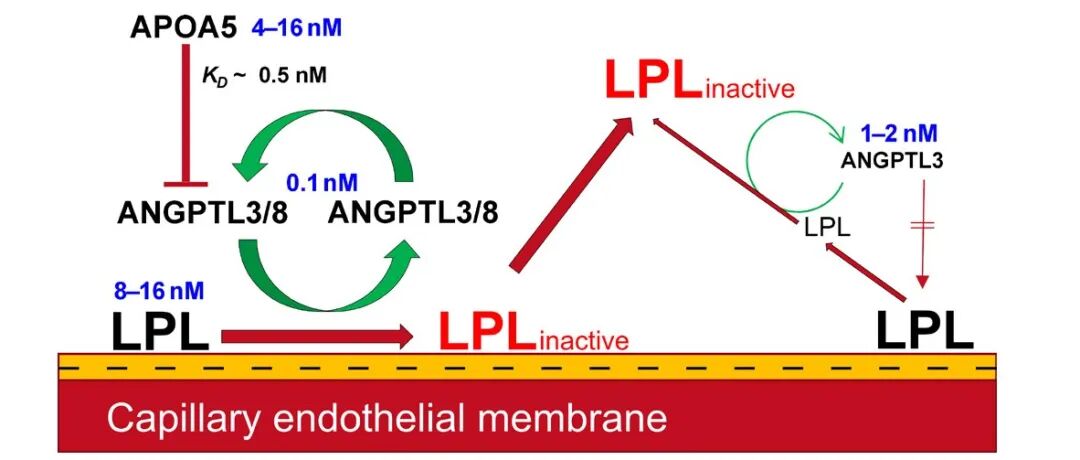
本文研究ANGPTL3/8复合物调控脂蛋白脂肪酶(LPL)活性的机制。背景方面,LPL是血管内脂解的关键酶,负责水解甘油三酯,但其结构不稳定,易失活,需ANGPTL蛋白调控。研究目的为阐明ANGPTL3/8如何抑制LPL活性。通过氢-氘交换质谱和热稳定性实验,发现ANGPTL3/8结合LPL的特定区域,催化其去折叠,降低热变性温度,破坏催化口袋,导致LPL失活。结论表明ANGPTL3/8是一种非典型去折叠酶,高效催化LPL失活,而GPIHBP1可拮抗此作用,为理解脂代谢调控提供了新见解。
本站注明稿件来源为其他媒体的文/图等稿件均为转载稿,本站转载出于非商业性的教育和科研之目的,并不意味着赞同其观点或证实其内容的真实性。如转载稿涉及版权等问题,请作者速来电或来函联系。
李惠琳课题组

Anal. Chem./使用毫秒级氢氘交换质谱法重新校准保护因子.
2025-12-18
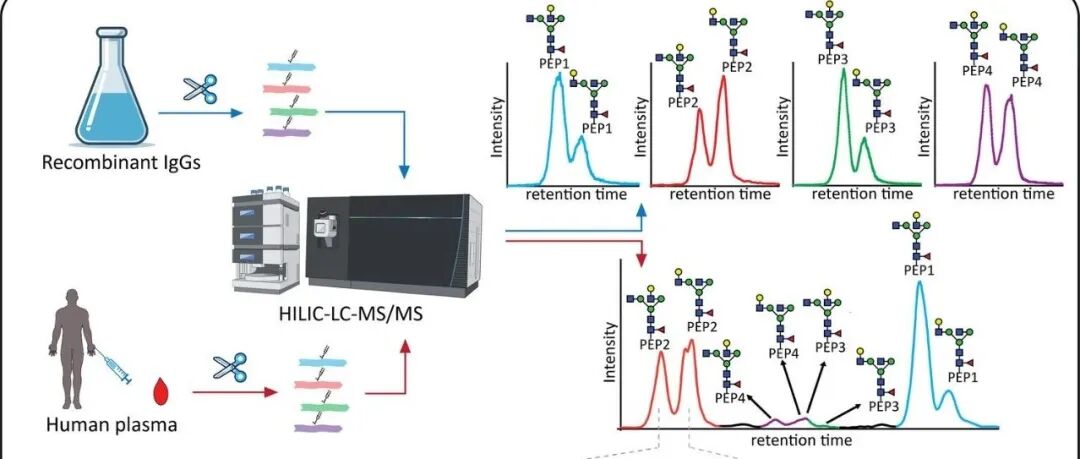
ACS Central Science|揭示人类IgG亚类N-糖基化结构元件上的差异.
2025-11-27
Anal.Chem./用于氢/氘交换质谱(HDX-MS)的巯基微流控芯片.
2025-10-16
最新文章

北大等高校集体官宣:严禁安装OpenClaw
10小时前