文献分享|淀粉样蛋白调节α-突触核蛋白的相分离和聚集
iFluorescence
2025-07-18 19:00
文章摘要
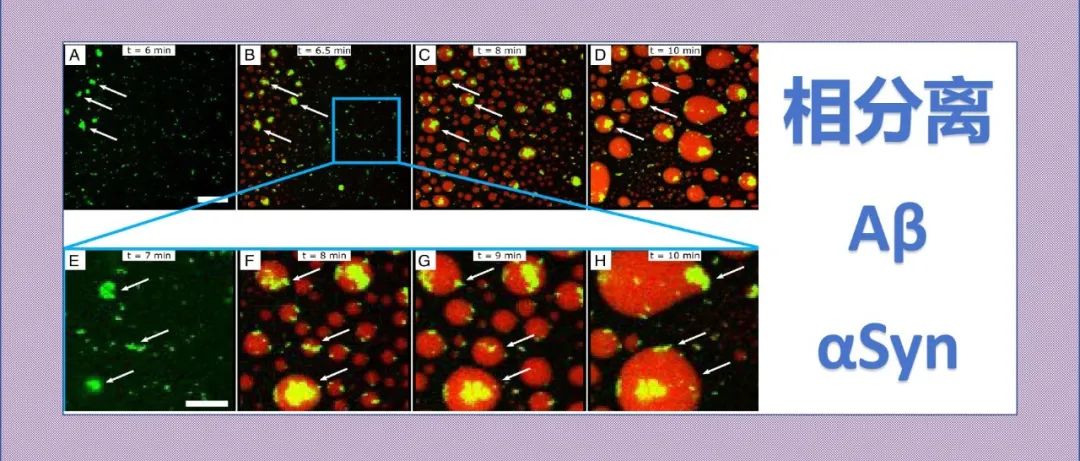
本文研究了β-淀粉样蛋白(Aβ)与α-突触核蛋白(αSyn)的相互作用,重点探讨了它们在共凝聚过程中的不同机制。研究发现,Aβ42和Aβ40对αSyn的凝聚动力学具有本质差异:Aβ42首先形成聚集体并作为异质成核位点引发αSyn的相分离,而Aβ40则以单体形式被包裹进入αSyn凝聚体,加速其向固态淀粉样聚集体的转变。其他Aβ变体如Aβ43、Aβ37、Aβ39和Aβ35-25也分别遵循这两种机制之一。这些发现揭示了蛋白质混合物在淀粉样蛋白形成过程中的高度敏感性,为理解Aβ与αSyn共凝聚和共聚集的机制提供了新的见解。
本站注明稿件来源为其他媒体的文/图等稿件均为转载稿,本站转载出于非商业性的教育和科研之目的,并不意味着赞同其观点或证实其内容的真实性。如转载稿涉及版权等问题,请作者速来电或来函联系。
推荐文献
Complex terrain causes global model prediction biases of 21.7 Zhengzhou extreme precipitation
DOI: 10.1016/j.scib.2025.09.015
Pub Date : 2026-01-30
Erratum: Combined HIF-1α blockade and CHIR99021 treatment reverses pulmonary fibrosis via modulation endothelial-to-mesenchymal transition.
DOI: 10.1016/j.isci.2026.114722
Pub Date : 2026-01-22
Date: 2026/2/20 0:00:00
Transboundary water conflicts, cooperation, and pathways forward.
DOI: 10.1073/pnas.2537439123
Pub Date : 2026-02-10
Date: 2026/2/4 0:00:00
iFluorescence
文献分享|蛋白质甲基丙烯酸化的化学选择性标记.
2025-11-14
文献分享|纳米级氧化还原铜的隔离作用调节溶菌酶聚集,维持脂质稳态,从而减轻线粒体健康.
2025-11-12
文献分享|铱(III)和铑(III)配合物对基因调控因子的直接靶向作用.
2025-10-29
最新文章

文献分享|蛋白质甲基丙烯酸化的化学选择性标记
2025-11-14

文献分享|具有双光学可调位点的深近红外至第二近红外区半花菁荧光团骨架,用于活体多通道成像
2025-11-13

文献分享|纳米级氧化还原铜的隔离作用调节溶菌酶聚集,维持脂质稳态,从而减轻线粒体健康
2025-11-12