上海药物研究所徐华强等合作最新Cell Discovery
iNature
2025-07-01 08:00
文章摘要
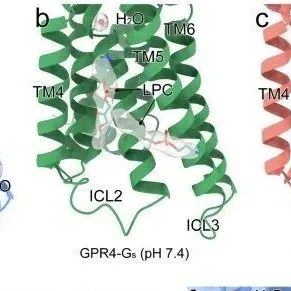
本文研究了质子感应G蛋白偶联受体GPR4在pH稳态中的分子机制。研究通过高分辨率冷冻电子显微镜结构揭示了GPR4在生理和酸性pH条件下与G蛋白复合物的结构变化,发现其质子感知机制由受体外侧结构域中的组氨酸网络驱动。酸性条件下关键组氨酸的质子化引发构象级联反应,并涉及跨膜螺旋重排和保守基序的构象变化。此外,研究还发现活性脂质溶血磷脂酰胆碱(LPC)对GPR4的激活具有正变构效应。这些发现为理解GPCRs的质子感应机制及pH相关疾病的治疗提供了新见解。
本站注明稿件来源为其他媒体的文/图等稿件均为转载稿,本站转载出于非商业性的教育和科研之目的,并不意味着赞同其观点或证实其内容的真实性。如转载稿涉及版权等问题,请作者速来电或来函联系。
推荐文献
Multilevel Regulation in RNA-Protein Hybrid Incoherent Feed-Forward Loop Circuits for Tunable Pulse Dynamics in <i>Escherichia coli</i>.
DOI: 10.1021/acssynbio.5c00111
Pub Date : 2026-02-03
Three-Component Glycosylation of Transient Hemiacetals Toward Tunable Aryl-Bisacetal Substrates.
DOI: 10.1021/acschembio.5c01026
Pub Date : 2026-02-04
Extra-helical allosteric binding site of apomorphine in ADGRG6.
DOI: 10.1038/s41421-025-00866-1
Pub Date : 2026-02-03
iNature
最新文章