Chem. Sci. | 亲和肽配体用于捕捉N-磷酸化蛋白质组
王初课题组
2025-05-26 20:00
文章摘要
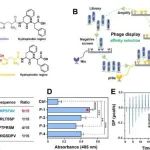
本文介绍了中国科学院大连化学物理所的江波副研究员和卿光焱研究员发表在Chem. Sci.上的研究。研究背景是可逆的蛋白质磷酸化是重要的翻译后修饰,而N-磷酸化因其在生命过程中的重要作用受到关注,但由于N-P键在酸性条件下不稳定,现有富集方法存在缺陷。研究目的是开发新的亲和肽配体来富集N-磷酸化肽段。通过噬菌体展示技术筛选出4条对磷酸基团有高亲和力的多肽配体,其中P-1配体亲和力最强。将P-1配体偶联到磁珠上,成功用于HeLa细胞中1995个新N-磷酸化位点的鉴定,检测深度增加2至5倍,并首次鉴定了细胞核中1296个N-磷酸化位点。此外,结合定量蛋白质组学方法研究了阿尔茨海默病进展中N-磷酸化修饰的动态变化。结论是该亲和肽配体为N-磷酸化蛋白质组研究提供了新工具。
本站注明稿件来源为其他媒体的文/图等稿件均为转载稿,本站转载出于非商业性的教育和科研之目的,并不意味着赞同其观点或证实其内容的真实性。如转载稿涉及版权等问题,请作者速来电或来函联系。
推荐文献
Issue Publication Information
DOI: 10.1021/apv008i002_2033340
Pub Date : 2026-01-23
Modulating Halide Leaving-Group Trends through Recognition by Bisboranes
DOI: 10.1039/d5sc10013e
Pub Date : 2026-02-06
Combating Antiviral Drug Resistance: A Multipronged Strategy
DOI: 10.1021/acs.accounts.5c00724
Pub Date : 2026-02-06
王初课题组

Nat. Commun. | 半胱氨酸-赖氨酸可断裂交联探针实现细胞蛋白质组互作解析.
2025-12-30

ACS Chem. Biol. | 靶向OTUB1的共价多肽探针.
2025-12-30

Nat. Chem. Biol. | 利用深度学习设计多功能基序蛋白质.
2025-12-29

Angew. Chem. Int. Ed. | 捕获焦谷氨酸化修饰的化学探针.
2025-12-29

科研回忆录 | 秦为:我的博士后经历回忆.
2025-12-26
最新文章

ACS Chem. Biol. | 靶向OTUB1的共价多肽探针
2025-12-30

Nat. Commun. | 半胱氨酸-赖氨酸可断裂交联探针实现细胞蛋白质组互作解析
2025-12-30

Angew. Chem. Int. Ed. | 捕获焦谷氨酸化修饰的化学探针
2025-12-29

Nat. Chem. Biol. | 利用深度学习设计多功能基序蛋白质
2025-12-29




