中国科学技术大学张凯团队合作最新Nature子刊
iNature
2026-02-02 09:49
文章摘要
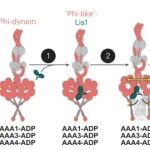
背景:动力蛋白-1是一种关键的微管马达蛋白,负责细胞内多种货物的运输,其功能激活需要克服自身的“phi”颗粒自抑制构象。Lis1蛋白被认为是解除该自抑制状态的关键调节因子,但具体机制尚不明确。研究目的:本研究旨在阐明Lis1解除动力蛋白-1自抑制作用的生化与结构机制,特别是探究核苷酸结合状态如何调控两者结合及动力蛋白构象变化。结论:研究发现,动力蛋白内部三个AAA核苷酸结合位点(AAA1、AAA3、AAA4)的核苷酸结合状态共同构成一个“编码”,精细调控着Lis1与动力蛋白的结合亲和力及化学计量比。特定的核苷酸状态促进形成1:1的动力蛋白-Lis1复合物,该复合物能直接诱导动力蛋白转变为开放的、非抑制构象;而1:2的复合物则与自抑制状态类似。冷冻电镜结构进一步揭示了Lis1通过其WD40结构域与动力蛋白连接结构域相互作用,从而打开自抑制构象的结构基础。这项研究从生化和结构层面明确了Lis1解除动力蛋白自抑制的机制。
本站注明稿件来源为其他媒体的文/图等稿件均为转载稿,本站转载出于非商业性的教育和科研之目的,并不意味着赞同其观点或证实其内容的真实性。如转载稿涉及版权等问题,请作者速来电或来函联系。
推荐文献
Integrated Metabolomic and Genomic Insights into Amino Acid Incorporation Within the Hybrid Polyketide-Alkaloid Antibiotic TLN-05220.
DOI: 10.1021/acschembio.5c00877
Pub Date : 2026-01-30
Microtubule depolymerization at kinetochores restricts anaphase spindle elongation
DOI: 10.1038/s41589-026-02143-y
Pub Date : 2026-01-30
A Minimal and Portable CRISPR Platform Based on Bifidobacterial Cas9 Enables Genome Editing in <i>E. coli</i> Nissle 1917.
DOI: 10.1021/acssynbio.5c00911
Pub Date : 2026-01-31
iNature
最新文章