PNAS | 西湖大学施一公合作解析拟南芥AUX1蛋白在未结合IAA状态和IAA结合状态下的三维结构
溪远讲植物科学
2025-08-05 09:02
文章摘要
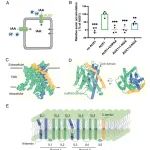
该研究通过冷冻电镜技术解析了拟南芥AUX1蛋白在未结合IAA状态和IAA结合状态下的三维结构。研究发现AUX1以单体形式存在,包含11个跨膜螺旋,其中TM1-TM5和TM6-TM10构成了典型的LeuT折叠结构域的两个半部分。在IAA结合状态下,IAA分子被特异性识别于由TM1、TM3、TM6和TM8形成的中心结合口袋中。研究还发现His249是底物摄取与释放过程中的关键氨基酸残基。该研究阐明了AUX1介导IAA结合与转运的分子机制,为理解生长素内流的分子机制提供了重要见解。
本站注明稿件来源为其他媒体的文/图等稿件均为转载稿,本站转载出于非商业性的教育和科研之目的,并不意味着赞同其观点或证实其内容的真实性。如转载稿涉及版权等问题,请作者速来电或来函联系。
推荐文献
Complex terrain causes global model prediction biases of 21.7 Zhengzhou extreme precipitation
DOI: 10.1016/j.scib.2025.09.015
Pub Date : 2026-01-30
Erratum: Combined HIF-1α blockade and CHIR99021 treatment reverses pulmonary fibrosis via modulation endothelial-to-mesenchymal transition.
DOI: 10.1016/j.isci.2026.114722
Pub Date : 2026-01-22
Date: 2026/2/20 0:00:00
Transboundary water conflicts, cooperation, and pathways forward.
DOI: 10.1073/pnas.2537439123
Pub Date : 2026-02-10
Date: 2026/2/4 0:00:00
溪远讲植物科学

年度巨献之——中国农业大学2025年度CNS正刊8篇.
2025-12-30

年度巨献之——山东农业大学2025年度CNS正刊3篇.
2025-12-30

年度巨献之——分子植物科学卓越创新中心2025年度CNS正刊13篇.
2025-12-30

岁律更新,盘点收获!年度巨献之——遗传发育所2025年度在CNS共发正刊13篇.
2025-12-30

关于国自然申请书改版,2026年面上/青C申请书改版分析.
2025-12-30
最新文章
【Dev Cell】 浙江大学武亮团队揭示高氮肥造成作物“贪青晚熟”的遗传与分子调控机制
2026-01-15

【JHMA】河南农业大学柳海涛副教授发表小麦响应锑胁迫的最新研究成果
2025-12-31

关于国自然申请书改版,2026年面上/青C申请书改版分析
2025-12-30

岁律更新,盘点收获!年度巨献之——遗传发育所2025年度在CNS共发正刊13篇
2025-12-30




