Angew. Chem. Int. Ed. | 位点特异性的光交联蛋白质组学策略解析非典型焦亡中Caspase-4底物网络
王初课题组
2025-03-21 20:00
文章摘要
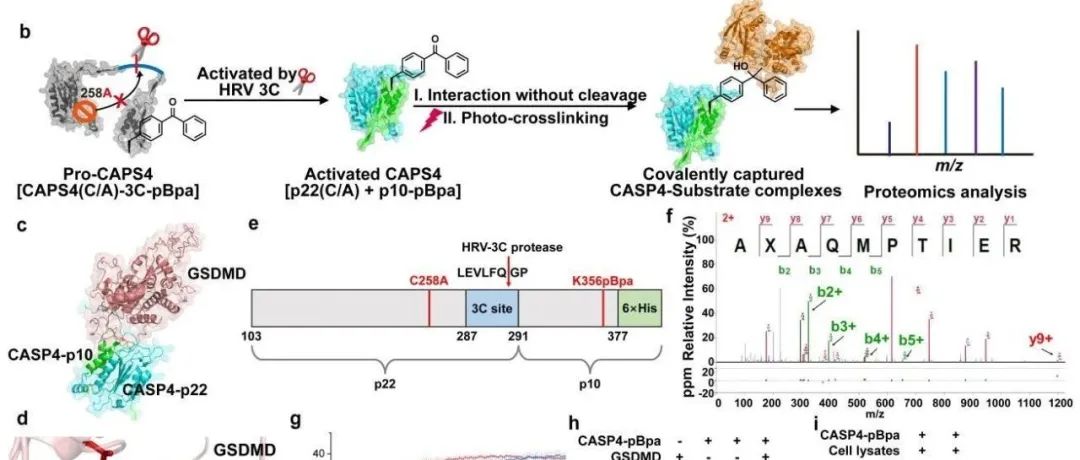
本文介绍了一种位点特异性的光交联蛋白质组学策略,用于解析非典型焦亡中Caspase-4的底物网络。研究通过遗传密码子扩展、光交联和蛋白质组学技术,成功鉴定了Caspase-4的156种潜在底物,并验证了其中16种蛋白的有效切割。特别关注了AKT1蛋白,发现其切割位点位于D108,可能影响AKT1的激活或定位。此外,研究还揭示了Caspase-4对同家族蛋白酶Caspase-5/12前体的激活作用,表明CASP4下游存在一个复杂的焦亡级联。这些发现为理解Caspase-4在非经典炎症中的作用提供了新的视角。
本站注明稿件来源为其他媒体的文/图等稿件均为转载稿,本站转载出于非商业性的教育和科研之目的,并不意味着赞同其观点或证实其内容的真实性。如转载稿涉及版权等问题,请作者速来电或来函联系。
推荐文献
Combating Antiviral Drug Resistance: A Multipronged Strategy
DOI: 10.1021/acs.accounts.5c00724
Pub Date : 2026-02-06
Issue Publication Information
DOI: 10.1021/apv008i002_2033340
Pub Date : 2026-01-23
Phase Separation of Nucleic Acids: Mechanisms, Properties, and Applications
DOI: 10.1002/anie.202523943
Pub Date : 2026-02-04
王初课题组

Nat. Commun. | 半胱氨酸-赖氨酸可断裂交联探针实现细胞蛋白质组互作解析.
2025-12-30

ACS Chem. Biol. | 靶向OTUB1的共价多肽探针.
2025-12-30

Nat. Chem. Biol. | 利用深度学习设计多功能基序蛋白质.
2025-12-29

Angew. Chem. Int. Ed. | 捕获焦谷氨酸化修饰的化学探针.
2025-12-29

科研回忆录 | 秦为:我的博士后经历回忆.
2025-12-26
最新文章

ACS Chem. Biol. | 靶向OTUB1的共价多肽探针
2025-12-30

Nat. Commun. | 半胱氨酸-赖氨酸可断裂交联探针实现细胞蛋白质组互作解析
2025-12-30

Angew. Chem. Int. Ed. | 捕获焦谷氨酸化修饰的化学探针
2025-12-29

Nat. Chem. Biol. | 利用深度学习设计多功能基序蛋白质
2025-12-29




