同种异体造血干细胞移植治疗BCR:: abl1阴性的非典型慢性髓系白血病后的长期生存:日本移植和细胞治疗学会成人CML/MPN和MDS工作组的全国回顾性研究
IF 10.1
1区 医学
Q1 HEMATOLOGY
引用次数: 0
摘要
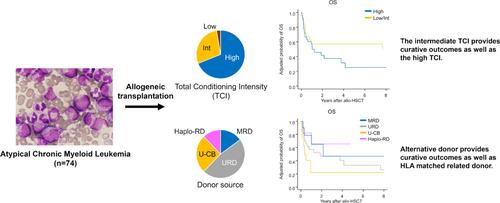
非典型慢性髓性白血病(aCML), BCR:: abl1阴性(也称为骨髓增生异常/骨髓增生性肿瘤[MDS/MPN]伴中性粒细胞增多)是一种罕见的血液系统疾病,骨髓和外周血中中性粒细胞增多。aCML通常预后很差,中位生存期约为2年。细胞减少疗法和新型分子药物是aCML的治疗选择,这些治疗的主要目的是改善症状和控制白血病细胞的增殖。同种异体造血干细胞移植(Allogeneic hematopoietic stem cell transplantation, alloo - hsct)是治疗aCML患者的一种很有前景的方法[3,4]。由于移植方式的最新进展,低强度调节(RIC)方案和替代供体(例如,无血缘关系的脐带血[U-CB]和人类白细胞抗原[HLA]-单倍体相同的相关供体[haploi - rd])越来越多地用于MDS/MPN患者[5,6]。然而,调节强度和替代供体对aCML患者移植后预后的影响尚不清楚。为了研究aCML患者移植后的治疗效果,我们在此进行了一项全国性的回顾性研究。原始数据集包括74名成年人(i)年龄在16岁或以上,(ii)被诊断为BCR:: abl1阴性aCML, (iii)在2003年1月1日至2021年12月31日期间接受了首次同种异体造血干细胞移植。根据总调理强度(TCI)评分,将调理方案的强度分为低、中、高三个等级。患者特征和调理方案见表S1和表S2。移植时的中位年龄为54岁(范围18-72岁)。从诊断到HSCT的中位时间为206天(范围10-1945天)。至于移植手术,51例(68.9%)接受了高TCI方案;分别有11例(14.9%)、35例(47.3%)、19例(25.7%)和9例(12.2%)患者使用hla匹配相关供体(MRD)、非相关骨髓/外周血干细胞供体(URD)、U-CB和单倍体- rd。在单倍型rd移植中,9例患者中有7例在移植后使用环磷酰胺作为移植物抗宿主病(GVHD)预防。中位随访时间为3.01年(四分位数间1.60 ~ 6.15年)(反向Kaplan-Meier法)。3年未调整的总生存率(OS)、慢性GVHD和无复发生存率(CRFS)、GVHD和无复发生存率(GRFS)分别为44.2%(31.7%-55.9%)、22.7%(13.1%-33.9%)和17.9%(9.5%-28.6%)(图S1)。3年未调整累计复发率(CIR)和非复发死亡率(NRM)分别为40.4%(28.5% ~ 51.9%)和25.5%(16.0% ~ 36.1%)(图S1)。第100天中性粒细胞移植的未调整发生率为90.5%(81.2% ~ 95.4%),第150天血小板恢复的未调整发生率为61.0%(48.9% ~ 71.1%)。第100天急性GVHD未调整的总发病率为43.2%(31.8% ~ 54.1%),3年慢性GVHD未调整的总发病率为37.2%(23.5% ~ 50.8%)。至于死亡原因,最常见的非复发死亡原因是特发性肺综合征(n = 5, 11.9%),其次是GVHD (n = 4, 9.5%)(表S3)。移植后治疗方面,无患者接受维持治疗以预防aCML复发。在29例移植后复发的患者中,3例患者接受了以供体淋巴细胞输注为基础的治疗,但没有一例出现aCML的反应。OS、CIR和NRM的多变量分析显示以下5个因素(表S4):(i)患者年龄(≥60岁)与更差的OS相关(风险比[HR], 3.18;95%置信区间[CI], 1.03-9.84;p = 0.045), (ii)单体7/del(7q)细胞遗传学异常的存在与较高的CIR相关(HR, 2.39;95% ci, 1.27-4.51;p = 0.007), (iii)从女性供体到男性受体的HSCT与较差的OS相关(HR, 2.94;95% ci, 1.44-6.00;p = 0.003), CRFS (HR, 2.18;95% ci, 1.23-3.87;p = 0.008), NRM (HR, 3.09;95% ci, 1.18-8.05;p = 0.021), (iv)以他克莫司为基础的预防与较差的OS相关(HR, 2.61;95% ci, 1.07-6.37;p = 0.034), (v) 2013 - 2021年HSCT与较好的NRM相关(HR, 0.28;95% ci, 0.10-0.82;p = 0.020)。未观察到TCI或供体来源的显著影响。两个因素与中性粒细胞植入发生率降低相关:使用U-CB (HR, 0.26;95% ci, 0.10-0.64;p = 0.003)和从女性供体到男性受体的HSCT (HR, 0.56;95% ci, 0.34-0.92;p = 0.023)(表S5)。与血小板恢复发生率较低相关的三个因素是:患者年龄(40-59岁)(HR, 0.39;95% ci, 0.17-0.87;p = 0.021), U-CB的使用(HR, 0.18;95% ci, 0.07-0.46;p < 0.001),以及使用低/中TCI方案(HR, 0.45;95% ci, 0.21-0.98;p = 0.045)。 没有与急性或慢性GVHD发病率相关的因素。接下来,我们通过条件反射强度来估计结果。在高、低/中TCI方案中,3年调整后的OS概率分别为37.3%(23.2%-59.9%)和57.1%(37.1%-88.0%)(图1A);CRFS的3年调整概率分别为27.2%(15.9% ~ 46.5%)和14.5%(4.4% ~ 48.1%)(图1B);GRFS的3年调整概率分别为26.6%(15.9% ~ 44.5%)和3.9%(0.4% ~ 41.2%)(图S2A);3年调整后的CIR分别为45.8%(31.3%-63.3%)和33.9%(17.3%-59.4%)(图1C);3年调整后的NRM分别为17.3%(9.0%-31.9%)和26.7%(12.1%-52.6%)(图1D)。在高、低/中TCI方案中,中性粒细胞移植的调整发生率分别为88.7%(77.7% ~ 95.8%)和93.9%(78.0% ~ 99.4%),血小板恢复的调整发生率分别为68.7%(55.0% ~ 81.6%)和41.2%(24.3% ~ 63.6%)(图1E、F)。调整后的GVHD累计发病率如图S2B、C所示。图1打开图查看器powerpoint移植后结果的调整生存分析。(A)总生存期(OS)、(B)慢性移植物抗宿主病(GVHD)无/无复发生存期(CRFS)的调整概率,以及(C)复发、(D)非复发死亡、(E)中性粒细胞植入和(F)血小板恢复的调整累积发生率通过总调节强度(高vs低/中等)显示。(G) OS、(H) CRFS的调整概率,以及(I)复发、(J)非复发死亡、(K)中性粒细胞移植和(L)血小板恢复的调整累积发生率,通过供体来源类型(hla匹配的相关供体[MRD]、非相关的骨髓/外周血干细胞供体[URD]、非相关的脐血[U-CB]、hla -单倍体相同的相关供体[haploo - rd])来显示。为了了解供体来源的作用,我们估计了供体来源的结果。在MRD、URD、U-CB和单倍型rd中,3年调整后的OS概率分别为60.8%(32.4% ~ 100.0%)、68.3%(44.5% ~ 100.0%)、37.5%(13.9% ~ 100.0%)和76.7%(50.7% ~ 100.0%)(图1G);CRFS的3年调整概率分别为29.2%(10.4% ~ 82.4%)、34.3%(19.9% ~ 59.2%)、31.5%(14.6% ~ 67.8%)、27.1%(7.3% ~ 100.0%)(图1H);GRFS的3年调整概率分别为42.8%(18.2% ~ 100.0%)、40.0%(18.9% ~ 84.6%)、40.2%(17.8% ~ 90.8%)和49.0%(20.2% ~ 100.0%)(图S2D);三年调整CIR 41.9%(19.9% - -73.7%), 42.0%(25.0% - -64.4%), 37.9%(20.4% - -63.0%)和38.5%(14.1% - -78.6%)(图1);三年调整全国抵抗运动是12.0%(20.2% - -55.1%),26.2%(9.1% - -61.7%),27.4%(9.5% - -64.3%),分别为和0.0%(图1 j)。在MRD、URD、U-CB和单倍型rd中,调整后的中性粒细胞着床率分别为96.3%(77.5% ~ 99.9%)、95.7%(85.4% ~ 99.4%)、84.4%(60.9% ~ 97.5%)和98.9%(80.4% ~ 100.0%),调整后的血小板恢复率分别为93.2%(68.7% ~ 99.8%)、90.6%(69.2% ~ 99.1%)、61.7%(33.3% ~ 89.7%)和96.5%(69.1% ~ 100.0%)(图1K,L)。调整后的GVHD累计发病率如图S2E、F所示。最重要的结果之一是,在高TCI和低/中等TCI方案之间,OS、CIR或NRM没有显著差异。RIC方案的EBMT也报告了类似的结果,尽管患者数量较少(n = 10)。这些结果表明低/中等TCI方案治疗aCML的潜力。由于aCML队列中老年患者(≥60岁)的比例很高,低/中等TCI方案可能会增加这些患者使用同种异体造血干细胞移植的机会。然而,低/中等TCI方案的血小板恢复发生率明显较低,这引起了对延迟造血恢复的担忧。为了确定有延迟造血恢复风险的特定亚群(例如,脾大和BM纤维化的存在)优先利用调节强度,未来需要进行大规模的研究。本研究报告了19例aCML患者U-CB移植的结果。虽然U-CB和MRD之间的OS没有明显差异,但调整后的生存曲线显示,U-CB的OS略差,这可能是由于更高的NRM。由于在我们的研究中,U-CB移植和使用低/中等TCI方案被确定为延迟造血恢复的重要危险因素,因此在aCML U-CB移植的情况下,高TCI方案将是首选。另一个重要的一点是,在我们的研究中,使用haploi - rd移植对于aCML也是可行的,这与之前关于haploi - rd治疗MDS/MPN bb0的结果一致。基于本研究中aCML患者数量较少(n = 9)和EBMT的研究(n = 5),很难得出关于使用单倍体rd治疗aCML的同种异体造血干细胞移植的明确结论。 然而,最近的进展,如移植后环磷酰胺和含有抗胸腺细胞球蛋白的调理方案,可能会增加aCML患者使用单倍rd进行同种异体造血干细胞移植的适应症。在寻找替代供体方面,使用U-CB和单倍- rd的同种异体造血干细胞移植从开始移植到移植的时间间隔通常比URD短。由于aCML患者的最佳桥接治疗尚未建立,医生需要在疾病进展高风险的aCML患者中选择这些替代供体(例如,白细胞增多、骨髓母细胞百分比、脾肿大、HSCT前骨髓高细胞、输血依赖和基因突变谱)。就U-CB移植中较低的造血恢复发生率而言,当从移植开始的早期就需要进行同种异体造血干细胞移植时,单倍- rd将比U-CB具有优势。总之,目前的低/中等TCI调节方案有潜力作为aCML的治疗选择,替代供体将用于达到治疗效果。这些结果表明,移植方式的发展将增加同种异体造血干细胞移植的机会,并使我们能够个性化管理aCML患者。为了最大限度地发挥同种异体造血干细胞移植的效益,需要进一步的临床研究来监测最小残留疾病并启动移植后治疗。本文章由计算机程序翻译,如有差异,请以英文原文为准。

Long-Term Survival After Allogeneic Hematopoietic Stem Cell Transplantation for BCR::ABL1-Negative Atypical Chronic Myeloid Leukemia: A Nationwide Retrospective Study by Adult CML/MPN and MDS Working Groups of the Japanese Society for Transplantation and Cellular Therapy
求助全文
通过发布文献求助,成功后即可免费获取论文全文。
去求助
来源期刊
CiteScore
15.70
自引率
3.90%
发文量
363
审稿时长
3-6 weeks
期刊介绍:
The American Journal of Hematology offers extensive coverage of experimental and clinical aspects of blood diseases in humans and animal models. The journal publishes original contributions in both non-malignant and malignant hematological diseases, encompassing clinical and basic studies in areas such as hemostasis, thrombosis, immunology, blood banking, and stem cell biology. Clinical translational reports highlighting innovative therapeutic approaches for the diagnosis and treatment of hematological diseases are actively encouraged.The American Journal of Hematology features regular original laboratory and clinical research articles, brief research reports, critical reviews, images in hematology, as well as letters and correspondence.

 求助内容:
求助内容: 应助结果提醒方式:
应助结果提醒方式:


